Voor uitgebreidere informatie m.b.t. de NVvH/HOVON richtlijnen: https:/hovon.nl/en/treatment-guidelines/lymphoma
Classificatie rijpe B-cel, rijpe T-cel en NK-cel maligniteiten
WHO-classificatie
Voor classificatie van non-Hodgkin lymfomen wordt de WHO-classificatie gebruikt. Alaggio et al, Leukemia. 2022. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms.
Stagering
Gereviseerd stagerings systeem voor primair nodale lymfomen (Lugano criteria)
| Stadium |
Betrokkenheid |
Extranodale (E) status |
| Limited |
| I |
1 lymfklier of groep aangrenzende lymfklieren |
1 extranodale lesie zonder lymfklier betrokkenheid |
| II |
≥2 lymfklier groepen aan dezelfde kant van het diafragma |
Stadium I of II door lymfklier uitbreiding met beperkte dichtbij gelegen extranodale betrokkenheid |
| |
|
|
| Advanced |
| III |
Lymfklieren aan beide kanten van het diafragma;
Lymfklieren boven het diafragma met milt betrokkenheid |
Niet van toepassing |
| IV |
bijkomende niet aansluitende extranodale betrokkenheid |
Niet van toepassing |
Opmerkingen:
- Uitbreiding van de ziekte wordt vastgesteld door gecombineerde PET-diagnostische CT scan voor avide lymfomen en door CT scan voor niet-avide lymfomen (zie later).
- NB: B symptomatologie (A of B stadium) wordt alleen nog bij het Hodgkin lymfoom aangegeven.
Referentie: Cheson BD, et al. Recommendations for initial evaluation, staging and response assessment of Hodgkin and non-Hodgkin lymphoma: The Lugano classification. J Clin Oncol 2014; 32: 3059-3067
Betrokkenheid van extralymfatisch weefsel aan één kant van het diafragma door beperkte directe uitbreiding van een naastgelegen nodale locatie wordt aangeduid als extranodale uitbreiding en weergegeven door de letter E. De E categorie kan ook een discrete enkele extranodale lesie aanduiden die past bij uitbreiding van een regionale betrokken lymfeklier. Uitgebreidere extranodale ziekte, b.v. multipele extranodale lesies, worden geduid als stadium IV. Een enkele extralymfatische locatie als de enige locatie van ziekte hoort als stadium IE te worden aangegeven.
NB:
- De volgende anatomische lymfeklier regio’s worden als een enkele regio beschouwd:
- alle klieren aan een kant van de hals, b.v. de subregio’s supraclaviculair, cervicaal, submandibulair, occipitaal, preauriculair en postauriculair;
- de okselregio omvat de infraclaviculaire klieren;
- het mediastinum wordt als een regio beschouwd, inclusief de subcarinale en pericardiale klieren.
- De longhilus wordt als een aparte regio beschouwd. Dus betrokkenheid van het mediastinum en een hilus lokalisatie betekent stadium II.
- Hilus klieren worden als gelateraliseerd beschouwd en als aan beide kanten positief dus stadium II.
- Tonsillen, Ring van Waldeyer en milt worden gezien als nodaal (lymfklier betrokkenheid).
Indeling risicogroepen
Klinische factoren DLBCL: IPI / AAPI
Risicogroepen AGRESSIEF NHL vlgs. International Prognostic Index (IPI) (NEJM 1993; 329: 987-994)
| Prognostisch ongunstige factoren: |
Leeftijd > 60 jaar
LD > 1 x normaal
Performance status ≥ 2
Stadium III of IV
> 1 extranodale lokalisatie |
| IPI: |
|
| Laag risico |
0 of 1 risicofactor |
| Laag intermediair risico |
2 risicofactoren |
| Hoog intermediair risico |
3 risicofactoren |
| Hoog risico |
4 of 5 risicofactoren |
| “Age adjusted” IPI (AAP I) geen punten voor extranodale lokalisaties; leeftijd vervalt |
| Laag risico |
Geen risicofactor |
| Laag intermediair risico |
1 risicofactor |
| Hoog intermediair risico |
2 risicofactoren |
| Hoog risico |
3 risicofactoren |
IPI risicogroepen voor patiënten behandeld met R-CHOP3
| Risicogroep |
Aantal kenmerken |
3-jaar PFS |
3-jaar OS |
| Laag |
0-1 |
87% |
91% |
| Laag-intermediair |
2 |
75% |
81% |
| Hoog-intermediair |
3 |
59% |
65% |
| Hoog |
4-5 |
56% |
59% |
Referentie: Ziepert M, et al. Standard international prognostic index remains a valid predictor of outcome for patients with aggressive CD20+ B-cell lymphoma in the rituximab era. J Clin Oncol 2010; 28: 2373-2380
Specifieke score voor oudere patiënten met DLBCL
De EPI (Elderly Prognostic Index) is een geriatrische score die specifiek voor agressief non-Hodgkin lymfoom is ontwikkeld en kan helpen om de fitheid van ouderen op een meer objectieve wijze te ondersteunen. Bij twijfel over fitheid bij een oudere patiënt, score bepalen en geriater betrekken.
Referentie: Merli F, Luminari S, Tucci A, et al. Simplified geriatric assessment in older patients with diffuse large B-cell lymphoma: the prospective elderly project of the Fondazione Italiana Linfomi. J Clin Oncol. 2021;39(11):1214-1222.
FLIPI
Risicogroepen folliculair lymfoom volgens Follicular Lymphoma International Prognostic Index (FLIPI) (Blood 2004; 104: 1258-1265)
NB: Hoewel deze index werd ontwikkeld op een cohort patiënten dat niet met rituximab werd behandeld, is inmiddels duidelijk geworden dat deze ook in het rituximab-tijdperk nog onderscheidend is.
FLIPI risicogroepen
| Prognostisch ongunstige factoren: |
Leeftijd > 60 jaar
Stadium III of IV
Hemoglobine < 7,4 mmol/l
Aantal nodale gebieden > 4
LD > 1 x normaal |
| Laag risico |
0 of 1 risicofactor |
| Intermediair risico |
2 risicofactoren |
| Hoog risico |
3 of meer risicofactoren |
MIPI
Risicogroepen mantelcel lymfoom volgens Mantelcel lymfoom International Prognostic Index (MIPI) (Blood. 2008; 111:558-565)
MIPI score
MIPI risicogroepen
| MIPI risicogroep |
MIPI score |
| laag risico |
< 5,7 |
| intermediair risico |
≥ 5.7 en < 6.2 |
| hoog risico |
≥ 6.2 |
IPSS-MW
Risicogroepen M Waldenström volgens International Prognostic Scoring System for Waldenström’s macroglobulinemia (IPSS-MW) (Blood. 2009;113:793-796)
International Prognostic Scoring System for Waldenström’s macroglobulinemia
| Item |
Score |
| leeftijd > 65 jaar |
1 |
| hemoglobine < 7,2 mmol/l |
1 |
| trombocyten aantal < 100 x 109/l |
1 |
| β2-microglobuline > 3 mg/l |
1 |
| IgM M-proteine > 70 g/l |
1 |
| Risicogroep |
Score |
Mediane overleving (maanden) |
| laag |
0-1 (m.u.v. leeftijd) |
143 |
| intermediair |
2, of leeftijd > 65 jaar |
99 |
| hoog |
≥ 3 |
44 |
BL-IPI
Risicogroepen Burkitt lymfoom volgens Burkitt Lymphoma International Prognostic Index (BL-IPI). (J Clin Oncol 2021; 39:1129-1138)
International Prognostic Scoring System for Burkitt Lymphoma
| Item |
Score |
| leeftijd > 40 jaar |
1 |
| PS 0-2 |
1 |
| LDH > 3 x ULN |
1 |
| CZS lokalisatie |
1 |
| Risicogroep |
Score |
3 jr OS |
| laag |
0 |
96% |
| intermediair |
1 |
76% |
| hoog |
2-4 |
59% |
Diagnostisch onderzoek
- Volledig bloedbeeld, leukocyten differentiatie, reticulocyten, bloedgroep, irregulaire antistoffen.
- LDH, kreatinine, bilirubine, leverenzymen, calcium, albumine, urinezuur, glucose.
- M-proteine + immunofixatie op indicatie (lymfoplasmocytair lymfoom, AITL).
- Directe antiglobulinetest en haptoglobine bij verdenking op hemolyse.
- Virusserologie (hepatitis B, C, HIV). (hepatitis B en C wegens risico op ernstige hepatitis bij immunotherapie (prednison, rituximab)
- EBV-PCR bij Burkitt lymfoom, PTLD en T-cellymfomen.
- Lymfeklier- of betrokken weefsel histologie (incl. gerichte immunohistochemie) met excisiebiopt (aangetoond superieur vergeleken met naald bioptenL Syrykh et al, Blood 2022, alleen indien dit niet mogelijk is een dikke naaldbiopt).
- Histologische materialen af te nemen volgens lymfoom protocol (vers op met fysiologisch zout bevochtigd gaas).
- Beenmergaspiraat morfologie en immunofenotypering, beenmerghistologie (biopt ≥ 2.5 cm lang). Bij DLBCL is BM onderzoek alleen nog nodig als er stamcellen worden verzameld en er een kleincellig component is, PET-CT is niet gevalideerd ter evaluatie van BM infiltratie in andere NHL lymfomen.
- FISH op indicatie (bijv. bij mantelcellymfoom (11;14), Burkitt lymfoom (8;14) of DLBCL (Myc, bcl-2, bcl-6)).
- Cytologie en immunofenotypering van punctaten (liquor, pleuravocht, ascites, BAL-vloeistof, etc.).
- PET-diagnostische CT scan hals, thorax en abdomen bij DLBCL, en bij FL indien stadium I (ter uitsluiting van uitgebreider stadium)
- Diagnostische CT scan hals, thorax en abdomen bij andere entiteiten/situaties. Grootte van lesies op CT vastleggen volgens Cheson criteria, bidimensionaal.
- Consult neurologie (stadiërings LP op indicatie) (zie Centraal zenuwstelsellymfoom).
- Consult andrologie op indicatie (fertiliteitsonderzoek, sperma invriezen).
- Counseling gynaecologie op indicatie.
Stagering en response criteria
Bij behandeling in studieverband moet gekeken worden naar de formulering in het protocol!
Beenmergdiagnostiek: Een histologisch normaal beenmergbiopt (inclusief immunohistochemie) met een kleine (< 2%) clonale B-cel populatie in de flowcytometrie moet beschouwd worden als normaal. Het beenmerg onderzoek moet worden herhaald indien dit voor aanvang positief was.
In 2014 zijn nieuwe stagering en response criteria vastgesteld voor maligne lymfoom. De vaststelling van de respons na afloop van de behandeling vindt bij FDG-avide lymfomen accurater plaats door middel van een PET-diagnostische CT scan. Er is geen plaats voor het verrichten van een mid-therapie PET scan buiten studieverband, gezien geen therapeutische consequenties. Uitzondering voor DLBCL beperkte stadium waarvoor interim PET na 3 cycli wel verder therapie bepaalt.
Referenties:
Cheson BD, et al. Recommendations for initial evaluation, staging and response assessment of Hodgkin and non-Hodgkin lymphoma: The Lugano classification. J Clin Oncol 2014; 32: 3059-3067)
Barrington S, et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the international conference on malignant lymphomas imaging working group. J Clin Oncol 2014; 32: 3048-3058
FDG aviditeit lymfomen
| FDG-avide lymfomen |
| Hodgkin Lymfoom (klassiek en niet klassiek) |
| DLBCL |
| Burkitt lymfoom |
| Lymfoblastair lymfoom |
| Folliculair lymfoom |
| Nodaal marginale zone lymfoom |
| Mantelcel lymfoom |
| Perifeer T-NHL, AITL, anaplastisch grootcellig lymfoom |
| NK/T cel lymfoom |
| |
| Variabel/non-FDG avide lymfomen |
| MALT lymfoom |
| Milt marginale zone lymfoom |
| SLL |
| Lymfoplasmacytair lymfoom |
| Enteropathie type T-cel lymfoom |
| Primair cutane B en T-cel lymfomen |
| Subcutaan panniculitis-like T-cel lymfoom |
Criteria voor betrokkenheid lesie
| Plaats lesie |
kliniek |
FDG-aviditeit |
test |
Positieve bevinding |
| Lymfklieren |
Palpabel |
FDG-avide lymfomen
Niet-avide lymfomen |
PET-CT
CT |
Verhoogde FDG uptake
Onverklaarde lymfklier vergroting |
| Milt |
Palpabel |
FDG-avide lymfomen
Niet-avide lymfomen |
PET-CT
CT |
Diffuse uptake, solitaire massa, miliaire lesies, nodules
Verticale lengte > 13 cm, massa’s, nodules |
| Lever |
Palpabel |
FDG-avide lymfomen
Niet-avide lymfomen |
PET-CT
CT |
Diffuse uptake, massa
Nodules |
| CZS |
Symptomen |
|
CT
MRI
liquor |
Massa’s
Leptomeningeale infiltratie, massa’s
Cytology en flow cytometrie |
| Andere (o.a. huid, GI, bot, BM, long) |
Afhankelijk
plaats |
|
PET-CT*, biopt |
Lymfoom betrokkenheid |
| *PET-CT is hoogst suggestief voor het aantonen van lymfoom betrokkenheid van extra-nodale lokalisaties. Confirmatie met een biopt kan indien nodig worden overwogen. |
Tijdens en na behandeling van het lymfoom worden de resultaten van de PET scan beoordeeld op basis van de Deauville score.
Deauville score PET scan (5-punten schaal)
| Score |
Uptake PET scan |
| 1 |
Geen residuale uptake |
| 2 |
Geringe uptake, echter lager dan de blood pool (in het mediastinum) |
| 3 |
Uptake, hoger dan het mediastinum, maar lager of gelijk aan de lever |
| 4 |
Uptake, iets meer dan de lever |
| 5 |
Uptake, evident meer dan de lever en/of nieuwe lesies |
Een Deauville score van 4 en 5 na afloop van de therapie wordt beschouwd als passend bij ziekteactiviteit. De scores van 1, 2, en 3 passen bij een metabole complete remissie.
Gereviseerde criteria voor respons: de Lugano criteria
| Respons en plaats |
PET-CT gebaseerde respons |
CT-gebaseerde respons |
| Complete respons |
Complete metabole respons |
Complete radiologische respons (alle volgende items) |
| Lymfklieren en extranodale lokalisaties |
Deauville score 1,2 of 3* met of zonder rest massa
*voor interpretatie van Deauville score 3 zie bovenstaande alinea |
De target lymfklieren/nodale massa’s moeten tot ≤ 1.5 cm in langste dwarse diameter afnemen.
Geen extranodale ziekte |
| Niet meetbare lesie |
Niet van toepassing |
Afwezig |
| Orgaan vergroting |
Niet van toepassing |
Afname tot normaal |
| Nieuwe lesies |
Geen |
Geen |
| Beenmerg |
Geen FDG-avide ziekte in BM |
Normale morfologie, als onduidelijk moet IHC negatief zijn |
| |
|
|
| Partiële respons |
Partiële metabole respons |
Partiële remissie (alle volgende items) |
| Lymfklieren en extranodale lokalisaties |
Deauville score 4 of 5 met verminderde uptake in vergelijking met baseline en restmassa’s van elke grootte |
≥ 50% afname in SPD (som van product van loodrechte diameters) van maximaal 6 target lesies en extranodale lokalisaties
Als een lesie te klein is om te meten op CT scan gebruik 5 x 5 mm
Als de lesie niet meer zichtbaar is gebruik 0 x 0 mm
Als een lymfklier > 5 mm x 5 mm is, maar kleiner dan normaal, gebruik de actuele waarde |
| |
Bij interim evaluatie suggereert dit responsieve ziekte |
|
| |
Bij eind evaluatie na behandeling is sprake van rest ziekte |
|
| Niet meetbare lesie |
Niet van toepassing |
Afwezig/normaal, afgenomen, maar niet toegenomen |
| Orgaan vergroting |
Niet van toepassing |
De milt moet > 50% in lengte (het verschil boven normaal) zijn afgenomen |
| Nieuwe lesies |
Geen |
Geen |
| Beenmerg |
Rest uptake hoger dan uptake in normaal BM, maar verminderd in vergelijking met baseline.
Bij persisterende focale afwijkingen in de context van een nodale respons moet overwogen worden om een MRI, biopt of later opnieuw een scan te maken |
Niet van toepassing |
| |
|
|
| Geen respons of stabiele ziekte |
Geen metabole respons |
Stabiele ziekte |
| Lymfklieren en extranodale lesies |
Deauville score 4 of 5 zonder significante verandering in vergelijking met baseline bij interim evaluatie of na behandeling |
< 50% afname in SPD van maximaal 6 target lesies en extranodale lokalisaties; geen criteria aanwezig voor progressieve ziekte |
| Niet meetbare lesies |
Niet van toepassing |
Geen toename passend bij progressie |
| Orgaan vergroting |
Niet van toepassing |
Geen toename passend bij progressie |
| Nieuwe lesies |
Geen |
Geen |
| Beenmerg |
Geen verandering in vergelijking met baseline |
Niet van toepassing |
| |
|
|
| Progressieve ziekte |
Progressieve metabole ziekte |
Progressieve ziekte vereist minstens 1 van de volgende criteria |
Individuele target lymfklieren/massa’s
Extranodale lokalisaties |
Deauville score 4 of 5 met toename in intensiteit uptake in vergelijking met baseline en/of
Nieuwe FDG-avide foci passend bij lymfoom bij interim evaluatie of na behandeling |
Een individuele lymfklier/lesie moet abnormaal zijn met:
Langste dwarse diameter > 1.5 cm en
Toename van ≥ 50% van PPD nadir (product van de langste dwarse diameter en diameter loodrecht daarop) en
Toename in vergelijking met nadir van langste dwarse diameter of kortste dwarse diameter loodrecht daarop:
0.5 cm voor lesies ≤ 2 cm
1.0 cm voor lesies > 2 cm
Bij splenomegalie:
De milt moet > 50% in lengte toenemen (het verschil boven normaal)
Indien milt normaal was bij baseline, dan toename van ≥ 2 cm
Nieuwe of terugkerende splenomegalie |
| Niet meetbare lesie |
Geen |
Nieuwe of duidelijke progressie van al aanwezige niet meetbare lesie |
| Nieuwe lesie |
Nieuwe FDG-avide foci passend bij lymfoom. Indien twijfel over oorzaak nieuwe lesie dan is biopt of latere nieuwe scan geïndiceerd |
Groei van lesie die eerder afgenomen was
Een nieuwe lesie > 1.5 cm in enige as
Een nieuwe extranodale lokalisatie > 1.0 cm in enige as; als < 1.0 cm in enige as dan moet het zeker dat het aanwezig is en dat het past bij lymfoom
Ziekte van elke grootte die onomstotelijk past bij lymfoom |
| Beenmerg |
Nieuwe of terugkerende FDG-avide foci |
Nieuwe of terugkerende betrokkenheid |
Interpretatie en tijdstip PET scans
- PET scan kan vals-positief zijn tgv rebound thymus hyperplasie, infectie, ontsteking, sarcoidosis of “brown fat”. Na gebruik van hematopoietische groeifactoren kan diffuse beenmerg-uptake optreden. Het interval na G-CSF toediening moet minstens 10 dagen zijn.
- De PET scan dient bij voorkeur 4 tot 6 weken na de laatste chemotherapie en 3 maanden na de laatste radiotherapie te worden verricht. minstens 10 dagen na G-CSF toediening.
- Indien bij responsevaluatie na afloop van de behandeling van FDG-avide lymfomen de PET-CT scan positief is, dient bij voorkeur PA bevestiging van actieve ziekte plaats te vinden, alvorens gestart wordt met salvage therapie. Wanneer dit niet praktisch haalbaar is, moet de PET-CT scan na 2-3 maanden worden herhaald.
- Follow-up evaluatie: Buiten studieverband is reguliere CT-scan en/of PET scan evaluatie niet zinvol en wordt ontraden.
Voor uitgebreidere informatie m.b.t. de NVvH/HOVON richtlijnen: https:/hovon.nl/en/treatment-guidelines/lymphoma/230220 Burkitt-richtlijn
Of: https://publicatie.nefro.nl/richtlijnen/burkitt-lymfoom-richtlijn-2022/
De diagnose Burkitt lymfoom wordt gesteld door middel van histologie, immunohistochemie en FISH (geïsoleerde Myc translocatie) in afwezigheid van bcl2 of bcl6 translocatie.
De prognose is gunstig als de patiënt behandeld kan worden met intensieve chemotherapie en CZS profylaxe. Dit dient plaats te vinden in het Erasmus MC.
Indien snelle behandeling geïndiceerd is kan in afwachting van de diagnose (PA en FISH moeten wel zijn afgenomen) gestart worden met cyclofosfamide 300 mg per dag en prednison 100 mg per dag gedurende drie dagen, of een R-CHOP kuur. Denk aan tumorlysis profylaxe. De kreatinine klaring dient > 50 ml/min te zijn voor start van de intensieve therapie.
Risicoclassificatie
Laag risico: de volgende factoren moeten allemaal aanwezig zijn:
- stadium I-II
- geen massa ≥ 7 cm
- normaal LDH
- WHO performance score 0 of 1
Hoog risico: alle overige patiënten.
Behandeling buiten studie verband:
Laag risico: Voorkeur 3 kuren dose modified Rituximab-CODOX-M en intrathecale CZS profylaxe. Alternatief DA-EPOCH-R 3-6 cycli (interim PET gestuurd) met intrathecale profylaxe.
Hoog risico: 2 kuren dose modified Rituximab-CODOX-M/Rituximab-IVAC en CZS profylaxe of 6 cycli DA-EPOCH-R met intrathecale CZS profylaxe. Indien er geen (verdenking op) CZS lokalisatie is, dan heeft DA-EPOCH-R de voorkeur, omdat hierbij minder infectieuze complicaties worden gezien, en dit een poliklinische behandeling is.
Patiënten boven de 75 jaar en/of slechte performance status: beleid individualiseren, R-CHOP met dose-modified MTX en CZS profylaxe
HIV gerelateerd Burkitt lymfoom: De behandeling BL in de context van HIV is gelijk aan die van HIV negatieve patiënten. Altijd antibiotische profylaxe (cotrimoxazol 2 dd 960 mg en fluconazol 1 dd 200 mg, indien andere combinatie altijd PJP profylaxe onafhankelijk van het CD4 getal). Altijd CZS profylaxe met MTX/dexamethason indien er een extranodale lokalisatie is.
Schema dose modified R-CODOX-M
| Day |
Drug |
Dose |
Route |
Time |
| Day 1 |
Cyclophosphamide |
800 mg/m2 |
i.v. |
In 30 minutes |
| Vincristine |
1.5 mg/m2 (max 2 mg) |
i.v. |
In 15 minutes |
| Doxorubicin |
40 mg/m2 |
i.v. |
In 15 minutes |
| Cytarabine |
70 mg |
i.t. |
|
| Rituximab |
375 mg/m2 (max 800 mg) |
i.v. |
According to local protocol |
| Day 2-5 |
Cyclophosphamide |
200 mg/m2 /day |
i.v. |
Daily in 30 minutes |
| Day 3 |
Cytarabine |
70 mg |
i.t. |
|
| Day 8 |
Vincristine |
1.5 mg/m2 (max 2 mg) |
i.v. |
In 15 minutes |
| Day 9 |
Rituximab |
375 mg/m2 (max 800 mg) |
i.v. |
According to local protocol |
| Day 10 |
Methotrexatea,b |
≤ 65 yr 300 mg/m2
> 65 yr 100 mg/m2 |
i.v. |
In 60 minutes |
Then:
≤ 65 yr 2700 mg/m2
>65 yr 900 mg/m2 |
i.v. |
Continuously over 23 h |
| Day 11 |
Leucovorinc |
100 mg |
i.v. |
36 h after start of i.v. MTX, in 30 minutes |
Then:
100 mg (i.v.) or 90 mg (p.o.) |
i.v. or p.o. |
Acc to appendix F |
| Day 13 |
Filgrastim |
≤ 80 kg 300 μg /day
> 80 kg 480 μg /day |
s.c. |
From day 13 onwards, daily until ANC > 1.0 ☓ 109/l |
| Day 15 |
Methotrexate |
15 mg |
i.t. |
|
with
Dexamethasone
or
Prednisoloned |
4mg
25mg |
i.t. |
|
| Day 16 |
Leucovorine |
15 mg |
p.o. |
24 h after i.t. methotrexate |
| a |
Dosages of methotrexate (MTX) conform dose-modified protocol11 |
| b |
MTX should only be given in the presence of normal serum creatinine for the patient’s age and a measured creatinine clearance of > 50 ml/min. Start MTX regardless of blood counts.
MTX plasma levels should be determined daily beginning 48 hours after start of MTX. |
| c |
Leucovorin: start leucovorin at 36 h after start of methotrexate infusion. |
| d |
i.t. dexamethasone or prednisolone may be given to avoid arachnoiditis according to local protocol. |
| e |
At day 16 leucovorin will be given p.o. after methotrexate i.t. to avoid cumulative methotrexate toxicity |
Schema dose-modified R-IVAC
De R-IVAC start op de dag dat het neutrofielen aantal > 1.0 x 109/L is (tenminste 3 dagen na stop filgrastim) met een trombocyten aantal van > 75 x 109/L (tenminste 3 dagen na laatste trombocyten transfusie). R-IVAC moet binnen 5 weken na start R-CODOX-M starten, maar na herstel van bloedbeeld zo snel mogelijk.
| Day |
Drug |
Dose |
Route |
Time |
| Day 1-5 |
Etoposide |
60 mg/m2 /day |
i.v. |
Daily over 1 h |
| Day 1-5 |
Ifosfamide |
≤ 65 yr 1500 mg/m2 /day
> 65 yr 1000 mg/m2 /day |
i.v. |
Daily over 1 h |
| Day 1-5 |
Mesna |
≤ 65 yr 300 mg/m2 /day
> 65 yr 200 mg/m2 /day
(mixed with ifosfamide) |
i.v. |
Daily over 1 h |
Then:
≤ 65 yr 300 mg/m2 /day
(2100 mg/m2 /day
> 65 yr 200 mg/m2 /day
(1400 mg/m2 /day |
i.v. |
3 hourly (7 doses /24 h period) |
| Day 1 and 2 |
Cytarabine |
≤ 65 yr 2000 mg/m2 /day
(4000 mg/m2 /day)
> 65 yr 1000 mg/m2 /day
(2000 mg/m2 /day) |
i.v. |
Over 3 hours, 12 hourly (total of 4 doses) |
| Day 3 |
Rituximab |
375 mg/m2 (max 800 mg) |
i.v. |
local protocol |
| Day 5 |
Methotrexate |
15 mg |
i.t. |
|
with:
Dexamethasone
or
Prednisolone |
4 mg
25mg |
i.t. |
|
| Day 6 |
Leucovorin |
15 mg |
p.o. |
24 h after i.t. methotrexate |
| Day 7 |
Rituximab |
375 mg/m2 (max 800 mg) |
i.v. |
Local protocol |
| Filgrastim |
≤ 80 kg 300 μg /day
> 80 kg 480 μg /day |
s.c. |
From day 7 onwards daily until ANC > 1.0 ☓ 109/l |
| a |
Dosages of ofosfamide and cytarabine conform dose-modified protocol.11 |
De volgende R-CODOX-M cyclus start op de dag dat het neutrofielen aantal > 1.0 x 109/L is (tenminste 3 dagen na stop filgrastim) met een trombocyten aantal van > 75 x 109/L (tenminste 3 dagen na laatste trombocyten transfusie). R-CODOX-M moet binnen 5 weken na start R-IVAC starten, maar na herstel van bloedbeeld zo snel mogelijk.
Patiënten die behandeld worden met R-CODOX-M/R-IVAC:
- Krijgen intensieve hematologische zorg
- Krijgen een triple lumen Hickman centrale lijn
- Let op doseringen MTX, ifosfamide en Cytarabine: is verschillend bij patiënten ≤ of > 65 jaar
- Worden geïsoleerd verpleegd, krijgen SDD en kiemarme voeding
- Krijgen penicilline profylaxe bij hoge dosis MTX en ARA-C
Schema Dose Adjusted EPOCH-R
Patiënten starten behandeling met DA-EPOCH-R in dose level 1 (zie tabel) In volgende cycli wordt de dosis voor doxorubicine, etoposide en cyclofosfamide verlaagd of verhoogd zoals beschreven in tabel, afhankelijk van de nadir van neutro’s en trombo’s.
Let op: G-CSF geven van d 6-15 of langer, na herstel van nadir, niet stoppen bij leucocytose.
Het is van belang in week 2 en 3 2 x per week, met minimaal 3 d ertussen, neutrofielen en trombocytenaantal te bepalen, om de nadir te kennen en volgende dose level te kunnen bepalen
Kuren a 21 dagen. Kuur uitstellen als neutro < 1, en tr < 75
| Day |
Drug |
Dose |
Route |
Time |
| Day 1 |
Rituximab |
375 mg/m2 |
i.v. |
According to local protocol |
Day 1
Cycle 1-4 |
Methotrexate
with
Dexamethasone
or
Prednisolone |
15 mg
4 mg
25 mg |
i.t. |
|
| Day 1-4 |
Etoposide |
Dependent on dose level |
i.v. |
Continuous infusion during 96 hrs. |
| Day 1-4 |
Doxorubicine |
Dependent on dose level |
i.v. |
Continuous infusion during 96 hrs. |
| Day 1-4 |
Vincristine |
0,5 mg/day |
i.v. |
Continuous infusion during 96 hrs. |
| Day 5 (cycle 1 and 2 only) |
Rituximab |
375 mg/m2 (max 800 mg) |
i.v. |
According to local protocol |
| Day 5 |
Cyclophosphamide |
Dependent on dose level |
i.v. |
bolus |
Day 5
Cycle 1-4 |
Cytarabine |
70 mg |
i.t. |
|
| Day 1-5 |
Prednisolon |
120 mg/m2/d |
p.o. |
60 mg/m2 twice daily |
| Day 6-15 or longer |
Filgrastim |
≤ 80 kg 300 µg/day
> 80 kg 480 µg/day |
s.c. |
From day 7 onwards daily until ANC > 5 x 109/L after nadir |
In totaal 8 profylactische i.t. injecties, dag 1 en 5 van kuur 1-4.
In totaal 8 infusen rituximab, in cyclus 1 en 2 op dag 1 en 5, vanaf cyclus 3 alleen dag 1.
Dose adjustments during DA-EPOCH-R
| Indien nadir ANC > 5 bij alle metingen |
1 dose level hoger dan vorige level |
| Indien nadir ANC < 5 bij alle metingen |
= dose level gelijk houden |
| Indien nadir ANC < 0,5 bij 3 metingen |
1 dose level lader dan vorige level |
| OF |
| Indien nadir trombo’s < 25 bij 1 of meer metingen |
1 dose level lager dan vorige level |
| Drug |
Dose per dose level |
| |
-2 |
-1 |
1 |
2 |
3 |
4 |
5 |
6 |
| Doxorubicine (mg/m2/d) |
10 |
10 |
10 |
12 |
14,4 |
17,3 |
20,7 |
24,8 |
| Etoposide (mg/m2/d) |
50 |
50 |
50 |
60 |
72 |
86,4 |
103,7 |
124,4 |
| Cyclophosphamide (mg/m2/d) |
480 |
600 |
750 |
900 |
1080 |
1296 |
1555 |
1866 |
Startdosis is dose level 1.
Lees meer >>
I. Primair centraal zenuwstelsellymfoom
Lokalisatie in hersenen, leptomeningeaal, liquor, retina of glasvocht (NB: lokalisaties epiduraal, cornea of conjunctiva zijn geen CZS lokalisatie).
Onderzoek
- Bloedbeeld, leukocyten differentiatie, bloedgroep, irregulaire antistoffen.
- LDH, kreatinine, Na, K, bilirubine, leverenzymen, calcium, albumine, urinezuur, glucose.
- Virusserologie (hepatitis B, C, HIV). (hepatitis B en C wegens risico op ernstige hepatitis bij immunotherapie (prednison, rituximab) Luesserologie, toxoplasmaserologie
- FDG-PET scan met diagnostische CT
- Consult neuro-oncologie
- Consult oogarts
- Consult andrologie op indicatie (fertiliteitsonderzoek, sperma invriezen).
- Counseling gynaecologie op indicatie
- MRI schedel met contrast (evt. CT schedel).
- LP: drukmeting (op indicatie), chemie, morfologie, immunofenotypering. Indien LP niet veilig mogelijk dan na 1e kuur CT of MRI hersenen ter beoordeling mogelijkheid LP en dan LP indien mogelijk
Behandeling
Geïsoleerd primair CZS lymfoom
De inductiebehandeling bij patiënten met een primair CZS lymfoom is MBVP, 2 kuren. (Er is onvoldoende evidence voor toevoeging van rituximab aan MBVP)
Na bereiken van CR of PR volgt een consolidatiekuur met ARA-C, 2 g/m2, 2 dd. dag 1 en 2.
Patiënten t/m 70 jaar komen hierna in aanmerking voor stamcelverzameling. Filgrastim start zoals bij andere kuren vanaf dag 4 na einde van de kuur, dus op dag 6.
Na succesvolle stamcelverzameling volgt autologe stamceltransplantatie, met conditionering carmustine/thiotepa.
Voorwaarde hiervoor is wel dat de patiënt voldoet aan de eligibility criteria voor autologe stamceltransplantatie, en tenminste een Karnofsky score heeft van 70. Eligibility dient voorafgaande aan de stamcelverzameling in kaart te worden gebracht.
Een alternatief voor autologe stamceltransplantatie bij patiënten jonger dan 60 jaar is schedelbestraling. Dit dient met patiënt te worden besproken.
Alternatief; indien HD-MTX niet mogelijk is: RT hersenen inclusief basale meningen (dosering afhankelijk van conditie van patiënt).
MBVP:
MBVP
| MTX |
3 g/m2 |
dag 1, 15 |
| VP16 (etoposide) |
100 mg/m2 |
dag 2 |
| Carmustine |
100 mg/m2 |
dag 3 |
| Prednison |
60 mg/m2 |
dag 1 – 5 |
Consolidatie ARA-C:
Cytarabine 2 g/m2, 2 dd. dag 1 en 2
Conditioneringsschema carmustine/thiotepa
Conditionering Carmustine/Thiotepa
| Carmustine |
400 mg/m2 |
dag -6 |
| Thiotepa |
5 mg/kg, 2 dd |
dag -5 en -4 |
| Stamcel re-infusie |
> 3,5 x 106 CD34+ cellen/kg |
dag 0 |
Indien keuze voor consolidatie radiotherapie:
Radiotherapie ter consolidatie wordt in principe alleen toegepast bij patiënten jonger dan 61 jaar. Bij oudere patiënten wordt bestraling bij het bereiken van een CR niet toegepast. Indien bij hen een PR wordt bereikt, wordt verder beleid in multidisciplinair overleg besproken.
- Indien CR:
- 20 x 1.5 Gy hersenen inclusief basale meningen (+/- orbitae)
- Indien PR:
- 20 x 1.5 Gy hersenen inclusief basale meningen (± orbitae) + geïntegreerde boost oorspronkelijke lymfoomlokalisatie 20 x 0.5 Gy
- 22 x 1.8 Gy hersenen inclusief basale meningen (± orbitae)
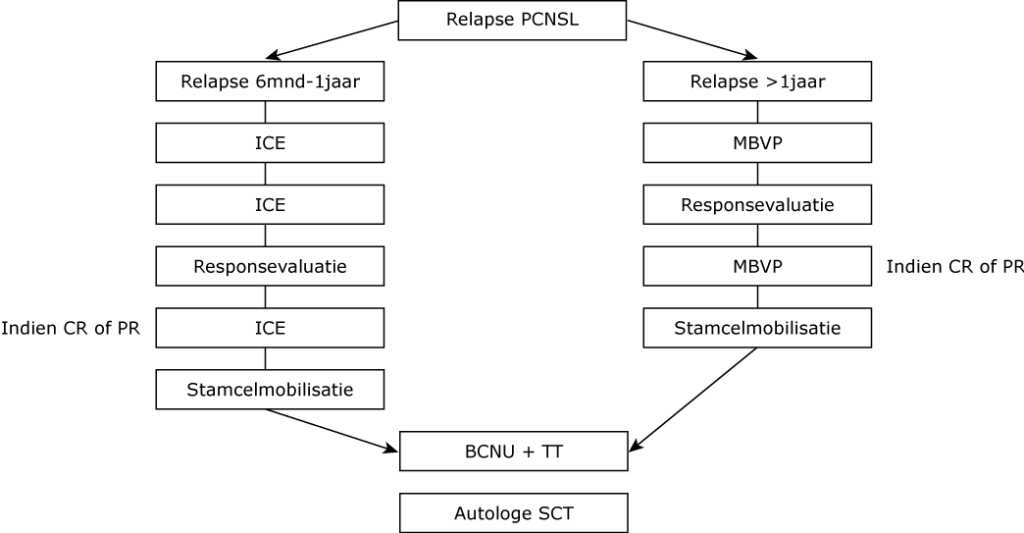
Behandeling bij recidief
Indien patiënten in eerste lijn nog geen ASCT hebben gehad, dan geeft inductiechemotherapie gevolgd door HCT+ASCT een betere OS en PFS in R/R PCNSL
t.o.v. chemotherapie zonder ASCT
t.o.v. radiotherapie (en minder(neuro)-toxiciteit)
Daarom bij geselecteerde groep patiënten:
- ≤ 70 jaar
- relapse PCNSL > 6 maanden na einde 1e lijns behandeling
- Karnofsky score: 70% of meer (evt. met dexamethason)
Reïnductiebehandeling gevolgd door autologe SCT met thiotepa in conditionering
Keuze reinductiebehandeling (zie figuur):
- relapse 6 mnd-1 jaar: 2 kuren ICE, waarna respons evaluatie;
indien CR of PR: 3e ICE kuur gevolgd door stamcelmobilisatie, conditionering met carmustine en thiotepa en autologe SCT
- relapse > 1 jaar: 1 kuur MBVP, waarna respons evaluatie;
indien CR of PR: 2e MBVP kuur gevolgd door stamcelmobilisatie, conditionering met carmustine en thiotepa en autologe SCT
ICE
| Etoposide |
100 mg/m2 |
dag 1, 2, 3 |
| Ifosfamide (met Mesna support) |
5 g/m2 |
dag 2 |
| Carboplatine |
AUC=5 (< 350 mg/m2 ) |
dag 2 |
Indien stamcelcollectie na MBVP: start Zarzio op dag 20 (4 dagen na de 2e MTX)
Indien stamcelcollectie na ICE: start Zarzio op dag 7
Conditionering CNS lymfomen:
dag -6: carmustine 400 mg/m2
dag -5 en -4: Thiotepa 5 mg/kg (elke 12 uur)
dag 0: autologe stamceltransplantatie: reïnfusie van > 3,5 x 106 CD34+ cellen/kg
Indien in eerste lijn al een ASCT heeft plaatsgevonden, of indien patiënt niet eligible is voor ASCT, dan moet het beleid individueel bepaald worden, afhankelijk van duur van de remissie en klinische conditie van de patiënt.
WBRT is een van de mogelijkheden indien niet eerder gegeven.
Een alternatief is lenalidomide 25 mg/d, 21-28 dagen
Check altijd beschikbaarheid studies
II. Leptomeningeale en/of intracerebrale lokalisatie(s) van systemisch NHL
Onderzoek
- Volledig stageringsonderzoek als bij NHL.
- Aanvullend:
- Consult neuroloog.
- MRI (evt CT) schedel + MRI wervelkanaal op indicatie.
- LP: drukmeting (op indicatie), chemie, morfologie + PA, immunofenotypering.
Behandeling
2a. Indien CZS lokalisatie in de eerste lijn
- Systemische behandeling van NHL met immuno-chemotherapie.
- Indien liquor positief:
R-CHOP afwisselend met 3 x hoge dosis methotrexaat (HD-MTX) intraveneus (start tussen dag 7 en 9), en intrathecaal behandeling met methotrexaat: herhaalde L.P.’s: methotrexaat 15 mg + dexamethason 4 mg, 2 x per week totdat liquor 2 x tumorvrij is (morfologie en flowcytometrie) maar tenminste 4 x, gevolgd door 2 toedieningen 1 x per week, daarna 2 injecties om de 2 weken en vervolgens 1 injectie per maand tot een totaal van 10-14 injecties. Indien geen respons optreedt switchen naar cytarabine 70 mg + dexamethason 4 mg i.t. volgens zelfde schema. Een intraveneuze MTX “telt” als een intrathecale toediening.
- Indien intracerebraal of evidente leptomeningeale lokalisatie op MRI:
tussen de kuren R-CHOP (tussen dag 7 en 9) hoge dosis methotrexaat (HD-MTX) intraveneus, totaal 6 x.
- Indien geen lokalisatie in liquor, dan geen it MTX.
- Indien ook liquor lokalisatie, dan bij symptomatische leptomeningeale lokalisatie ook intrathecale behandeling met MTX. Indien asymptomatisch, dan controle LP na 2 x MTX iv. Indien dan nog steeds lokalisatie in liquor, dan it MTX toevoegen, op de dag van de CHOP, en 2 x per week tot liquor schoon. (MTX iv telt mee als gift). Als liquor schoon is geworden afgebouwd zoals bij positieve liquor, zie hierboven.
- Geen radiotherapie ter consolidatie na bereiken CR. Bij PR valt consolidatie RT te overwegen bij patiënten ≤ 60 jaar. (Op MDO te bespreken)
- Bij lokalisatie intracranieel:
- Indien PR van intracerebrale lesie na uitgebreide systemische therapie (i.v en evt. i.t.): 20 x 1,5 Gy hersenen inclusief basale meningen + geïntegreerde boost op oorspronkelijke lymfoomlokalisatie 20 x 0,5 Gy, of 22 x 1,8 Gy hersenen inclusief basale meningen.
- Indien PR van extracerebrale lesie na uitgebreide systemische therapie (i.v en evt. i.t.): 18 x 2 Gy op de oorspronkelijke extracraniële, leptomeningeale lokalisatie.
De dosering kan eventueel worden aangepast afhankelijk van lymfoom entiteit (denk aan Burkitt lymfoom)
- Bij patiënten > 60 jaar & PR na systemische therapie: individualiseer beleid met betrekking tot radiotherapie (i.v.m. verhoogde kans op neurotoxiciteit na RT)
2b. Indien CZS lokalisatie als eerste uiting van een recidief, of gelijktijdig met een systemisch recidief
Indien < 70 jaar: volgens HOVON 80 schema: R-DHAP en op dag 14 HD-MTX, en intrathecaal methotrexaat bij positieve liquor. Indien na twee kuren tenminste PR en liquor en beenmerg negatief dan na 3e R-DHAP stamcelcollectie, daarna 3e kuur HD-MTX, en dan autologe stamcel transplantatie. Conditionering met carmustine/thiotepa. Indien het CZS recidief heel laat optreedt, (>5 jaar na primaire diagnose) kan overwogen worden te behandelen met MBVP (en geen therapie gericht op eventuele systeemlokalisatie).
Conditionering CNS lymfomen:
dag -6: carmustine 400 mg/m2
dag -5 en -4: Thiotepa 5 mg/kg (elke 12 uur)
dag 0: autologe stamceltransplantatie: reïnfusie van > 3,5 x 106 CD34+ cellen/kg
Radiotherapie hersenen inclusief basale meningen kan indien geen CR bereikt is in multidisciplinair overleg worden overwogen.
Indien > 70 jaar:
Palliatieve therapie d.m.v.:
- Radiotherapie van de symptomatische lokalisatie. Dosering afhankelijk van ziektebeloop en conditie van patiënt.
III Profylactische behandeling bij hoog risico op CZS lokalisatie NHL
Indicaties: risico op CZS lokalisatie > 10%
- Burkitt lymfoom, lymfoblastair lymfoom
- Lokalisatie(s) van grootcellig lymfoom in testis/ovarium, nier, bijnier.
- Lokalisatie(s) van grootcellig lymfoom in mamma én hoog LDH.
- Lymfoom bij HIV-positiviteit, als extranodale lokalisatie aanwezig is.
- High grade lymphoma “dubbel hit lymfoom” (high-grade B-cell lymphoma, with myc and BCL2 and/or BCL6 rearrangements)
- Intravasculair B-cellymfoom
- CNS-IPI score 5-6 (Schmitz et al, CNS International Prognostic Index: a risk model for CNS relapse in patients with DLBCL treated with R-CHOP. J Cli. Oncol. 2016;34:3150-6)
CNS-IPI risicofactoren:
- nier en/of bijnier lokalisatie
- leeftijd > 60 jaar
- LDH > normaal
- ECOG performance status > 1
- stadium III/IV
- > 1 extranodale lokalisatie
Profylaxe
- 2 giften HD-MTX, starten op dag 7-9 van R-CHOP kuur 2 en 3 tenzij gecontraindiceerd (alternatief: na einde van R-CHOP behandeling)
- Bij primair testislymfoom ook toevoegen van 4 giften intrathecale MTX
- Bij R-CHOP kuur 1 eenmalig LP voor diagnostiek: indien liquor localisatie aangetoond dan intensievere CZS behandeling conform secundair CZS lymfoom
NB overweeg bij intravasculair lymfoom 6 x MTX iv.
Bij oudere patiënten terughoudend met CZS profylaxe
IV Indicaties voor diagnostische LP, ter uitsluiting van CZS lokalisatie
Indicaties: risico op CZS lokalisatie 5-10%
- CNS-IPI 3 met epidurale lokalisatie
- CNS-IPI 4
V Thrombocyten transfusie voor LP
Landelijke transfusie richtlijn: Streef thrombocytenwaarde > 20 x 109/L
Lees meer >>
Voor uitgebreidere informatie m.b.t. de NVvH/HOVON richtlijnen: https:/hovon.nl/en/treatment-guidelines/lymphoma/ DLBCL
Of: https://publicatie.hematologienederland.nl/richtlijnen/diffuus-grootcellig-b-cel-non-hodgkin-lymfoom
Initiële therapie
Studies in de eerste lijn
Raadpleeg altijd de HOVON/LLPC website.
Eerste lijnsbehandeling DLBCL buiten studieverband
| Stadium I/II beperkt |
Geen bulk, aaIPI 0 en < 60 jaar en iPET negatief (DS 1-3) |
2 opties:
3 x R-CHOP21 + INRT
OF
4 x R-CHOP21 + 2R |
| |
Bulk en/of iPET positief (DS 4-5) |
3 x R-CHOP21 + INRT
Alternatief: 6 x R-CHOP21 (bijv. als RT niet gewenst is wegens lokalisatie lymfoom). Bij beperkte restlaesie op PET scan na chemotherapie overweeg radiotherapie
|
| Stadium II-IV |
< 70 jaar of > 70 jaar en fit |
Voorkeur 6 x R-CHOP21 + 2R
Alternatief is iPET na 2 kuren, en indien negatief de 2R weglaten |
| |
Niet fitte ouderen* |
6 x R-miniCHOP (of 6 x R-miniCEOP bij contra-indicatie voor anthracyclines) |
| |
Frail patiënten / geen absolute leeftijdgrens |
Geen curative opties, overweeg radiotherapie, R-CVP |
| *na screening EPI/sCGA en echo cor +/- verwijzing onco cardio |
Algemene principes R-CHOP toediening en evaluatie respons
- Poliklinische kuren (opname alleen op indicatie)
- Cardiologische screening systematische bij patiënten >65 jaar en op indicatie bij jongere patiënten (bv indien pre-expositie aan anthracyclines of cardiale voorgeschiedenis)
- Eventueel prefase geven met prednison 1 dd 100 mg gedurende 5 dagen (vooral overwegen bij ouderen en/of grote tumorload)
- Start tumor lysis profylaxe met allopurinol bij hoog LDH, hoog urinezuur of hoge tumorload
- Geen indicatie SDD, valaciclovir of cotrimoxazol profylaxe
- Geen standaard G-CSF profylaxe, ongeacht leeftijd. Overweeg wel pegfilgrastim 6 mg op dag 2 op indicatie.
- Bij ernstige algemene malaise/moeheid tijdens R-CHOP na de prednison kan de prednison worden afgebouwd in 3 dagen vanaf dag 5: 50 mg-25 mg-10 mg. Indien dit niet helpt kan hydrocortison worden gegeven oraal: 20 mg bij het opstaan in de ochtend en 10 mg om 12.00 uur
- Interim responsevaluatie vindt plaats na 3 kuren middels CT scan om progressieve ziekte uit te sluiten. Minstens 10 dagen na kuur toediening. Er wordt geen interim PET-CT verricht wegens gebrek aan therapeutische consequenties, met uitzondering PET-gestuurd beleid in beperkte stadia.
- Responsevaluatie na afloop van de R-CHOP middels PET scan. Vaak volstaat low-dose CT
- De PET scan dient bij voorkeur 4 tot 6 weken na de laatste chemotherapie en 3 maanden na de laatste radiotherapie te worden verricht.
- Indien bij responsevaluatie na afloop van de behandeling de PET-CT scan positief is, dient bij voorkeur PA bevestiging van actieve ziekte plaats te vinden, alvorens gestart wordt met 2de lijnstherapie. Wanneer dit niet praktisch haalbaar is, moet de PET-CT scan na 2-3 maanden worden herhaald.
R-CHOP-21
| Rituximab |
375 mg/m2 i.v |
dag 1 |
| Cyclofosfamide |
750 mg/m2 i.v. |
dag 1 |
| Doxorubicine |
50 mg/m2 i.v. |
dag 1 |
| Vincristine |
1.4 mg/m2 i.v. (max. 2 mg) |
dag 1 |
| Prednison |
100 mg oraal |
dag 1-5 |
| Kuur herhalen op dag 22 |
Dosisaanpassing richtlijnen
Geen dosisaanpassing bij eerste kuur.
Indien op dag 1 van volgende kuur neutrofielen < 1,0 x 109/l en/of trombocyten < 80 x 109/l, dan de kuur 3-4 dagen uitstellen en opnieuw bloedbeeld bepalen. Als dan deze waarden nog steeds niet zijn bereikt nogmaals 3-4 dagen uitstel. Tot deze waarden zijn bereikt elke 3-4 dagen controle. Wanneer het bloedbeeld voldoende is hersteld, dan de dosis aanpassen op geleide van onderstaande tabel:
| Delay of next cycle |
cyclophosphamide |
doxorubicin |
vincristine |
prednisone |
| 0 to 7 days |
100% |
100% |
100% |
100% |
| 8 to 14 days |
75% |
75% |
100% |
100% |
| > days |
50% |
50% |
100% |
100% |
CEOP schema voor patiënten met contraindicatie voor anthracyclines
CEOP
| Cyclofosfamide |
750 mg/m2 i.v. |
dag 1 |
| Etoposide |
50 mg/m2 i.v |
dag 1 |
| Vincristine |
1.4 mg/m2 (max. 2 mg) i.v. |
dag 1 |
| Prednisolon |
100 mg p.o. |
dag 1-5 |
| Etoposide |
100 mg/m2 p.o |
dag 2,3 |
| Kuur herhalen op dag 22 |
Mini-R-CHOP schema (Peyrade F, et al. Lancet Oncol 2011)
R-mini-CHOP
| Rituximab |
375 mg/m2 i.v. |
dag 1 |
| Cyclofosfamide |
400 mg/m2 i.v. |
dag 1 |
| Doxorubicine |
25 mg/m2 i.v. |
dag 1 |
| Vincristine |
1 mg i.v. |
dag 1 |
| Prednison |
40 mg/m2 p.o. |
dag 1-5 |
| pegfilgrastim |
6 mg s.c. |
dag 2 |
| Kuur herhalen op dag 22 bij neutrofielen > 1.0 x 109/L en trombocyten >100 x 109/L. Stel de kuur 1 week uit als deze waarden nog niet bereikt zijn. |
Recidief of refractair DLBCL
Tweedelijnsbehandeling
Studies in tweede lijn: zie KMS (intern Erasmus MC) en HOVON/LLPC website.
Buiten studieverband – patiënten eligible voor autologe stamceltransplantatie
Tweedelijn “salvage” chemotherapie: voorkeur 2 x R-GDP (want poliklinisch)
- R-DHAP, R-DHAO, R-DHAC of R-ICE zijn acceptabele alternatieven op indicatie, afhankelijk van pre-existente toxiciteit of orgaan dysfunctie (denk bv. aan polyneuropathie of ototoxiciteit).
- Bij onvoldoende respons na de 2 eerste cycli: stop chemotherapie en start CAR-T traject indien patiënt eligible met doel spoedige leukaferese (zie CAR-T)
Response evaluatie middels CT-scan na 2 cycli:
- Bij bereiken van PR/CR 3e kuur met aansluitend stamcel oogsten (Zarzio starten volgens agenda iom Hemaferese afdeling). Vervolgens autologe stamceltransplantatie na BEAM conditionering indien patiënt eligible is. Na de 3de kuur wordt alleen bij patiënten met een getransformeerd lymfoom of patiënten die primair refractair waren op eerstelijns therapie de remissie status nogmaals gecontroleerd middels CT-scan
- Indien geen succesvolle ferese, 2de poging tot stamcelcollectie met donorschema.
- Indien onvoldoende response (<50% afname targetlaesies of nieuwe laesies): CAR-T cel therapie, streef naar spoedige leukaferese (zie CAR-T). NB: asymptomatische CZS lokalisatie is geen absolute contra-indicatie voor CAR-T cel therapie (alle patiënten te bespreken in landelijke tumorboard).
Buiten studieverband: patiënt niet eligible voor ASCT
Er zijn verschillende opties. Keuze wordt gemaakt op basis van de klinische presentatie, de performance status en de co-morbiditeiten. Als de patient nog kandidaat is voor CAR-T cel therapie in 3de lijn, kies minder lymfodepleterende therapie en geef geen Bendamustine in 2de lijn.
- R-PECC
- (R-)Lenalidomide
- R-Gemox,
- (Polatuzumab)-bendamustine-rituximab
- Pixantrone i.v is geregistreerd voor de 3e of 4e lijn
- Radiotherapie
Derde lijnstherapie
Na falen van 2 lijnen systeemtherapie (ongeacht ASCT):
CAR-T cel therapie, streef naar spoedige leukaferese (zie CAR-T).
Recidief na CAR-T cel therapie
Voor recidief na CAR-T cel therapie is er geen standaard behandeling.
Overweeg:
- Fase I-II studie
- Reïnductie en allogene stamceltransplantatie
- Best supportive care
(R) GDP
| Dexamethason |
40 mg i.v. of oraal |
dag 1-4 |
| Gemcitabine |
1000 mg/m2 i.v. |
dag 1 en dag 8 |
| Cisplatin |
75 mg/m2 i.v. |
dag 1 |
| Rituximab |
375 mg/m2 i.v. |
dag 1 |
| Kuur herhalen op dag 21 (bij langdurige hematologische toxiciteit kuur uitstellen en Pegfilgrastim overwegen bij volgende cyclus). |
(R) DHAP
| Dexamethason |
40 mg i.v. of oraal |
dag 1-4 |
| Cisplatinum |
100 mg/m2 i.v. |
dag 1 |
| Cytarabine |
2 x 2000 mg/m2 i.v. |
dag 2 |
| Rituximab |
375 mg/m2 i.v. |
dag 1 |
| Kuur herhalen op dag 21 (bij langdurige hematologische toxiciteit kuur uitstellen en Pegfilgrastim overwegen bij volgende cyclus). |
(R) VIM
| Rituximab |
375 mg/m2 i.v. |
dag 1 |
| Etoposide |
90 mg/m2 i.v. |
dag 2, dag 4, en dag 6 |
| Methotrexaat |
30 mg/m2 i.v. |
dag 2 en dag 6 |
| Ifosfamide en Mesna |
1200 mg/m2 i.v. |
dag 2-6 |
| Kuur herhalen op dag 22 |
PECC
| Prednison |
40 mg/m2 p.o. |
dag 1-5 |
| Etoposide |
100 mg/m2 p.o. |
dag 1-5 |
| Lomustine* (Cecenu, Belustine®) |
80 mg/m2 p.o. |
dag 1 |
| Chloorambucil |
8 mg/m2 p.o. |
dag 1-5 |
| *Lomustine is beschikbaar in 40 mg capsules |
| Kuur herhalen op dag 29 |
Fase I/II studies (zie ook https://hovon.nl/nl/trials/geassocieerde-studies/llpc of zie KMS, trials hematologie (intern Erasmus MC).
Speciale entiteiten
High Grade B-cel lymfoom
HGBL (high grade B-cel lymfoom, voorheen ook double/tripel hit lymfoom genoemd) is een agressief B-cel lymfoom met MYC en BCL2 en/of BCL6 translocatie” (DH/TH), een variant van agressief B-cel lymfoom. (p9 van hovon richtlijn)
Bij elk DLBCL dient MYC-FISH te worden bepaald, en indien positief, ook BCL2 en BCL6 FISH.
- Stadium I: behandeling als DLBCL
- Stadium II-IV en fit: 6 x DA-EPOCH-R, of 1 x R-CHOP en 5 x DA-EPOCH-R. (schema, zie onder Burkitt lymfoom). Hierbij ook intrathecale CZS profylaxe.
Alternatief: 6 x R-CHOP met lenalidomide 15 mg/d per os, d 1-15. Dan ook CZS profylaxe. Daarbij pegfilgrastim, trombose profylaxe (aspirine of LMWH) en PJP profylaxe.
DLBCL, testislokalisatie
- Stadium I: na orchidectomie 6 x R-CHOP-21 + RT contralaterale testis. Tevens CZS profylaxe (zie CZS profylaxe).
- Stadium II-IV: als DLBCL + CZS profylaxe (zie CZS profylaxe) gevolgd door RT contralaterale testis
DLBCL, primair mediastinaal
- Stadium I: 3 x R-CHOP-14 gevolgd door involved field RT. Indien bulky overweeg behandeling als stadium II.
- Stadium II-IV: 6 x R-CHOP-14, gevolgd door involved field RT. (indien PET na chemotherapie negatief is hoeft geen aanvullende radiotherapie te worden gegeven)
R-CHOP-14
| Rituximab |
375 mg/m2 i.v |
dag 1 |
| Cyclofosfamide |
750 mg/m2 i.v. |
dag 1 |
| Doxorubicine |
50 mg/m2 i.v. |
dag 1 |
| Vincristine |
1.4 mg/m2 i.v. (max. 2 mg) |
dag 1 |
| Prednison |
100 mg oraal |
dag 1-5 |
Pegylated G-CSF
(Pegfilgrastim) |
6 mg s.c. |
dag 2 |
| Kuur herhalen op dag 15 |
HIV gerelateerd DLBCL
(Burkittlymfoom, zie Behandeling van Burkittlymfoom)
De behandeling van agressieve lymfomen bij HIV is analoog aan die van HIV negatieve patiënten ongeacht het CD4 getal. Belangrijk is dat er met cART moet worden gestart, in overleg met infectieziekten, en dat er goede infectieprofylaxe wordt gegeven met cotrimoxazol 2 dd 960 mg, fluconazol 1 dd 200 mg en G-CSF bij neutropenie. Bij patiënten die al cART krijgen moet soms de ART worden aangepast in verband met medicatie interacties. Er is een verhoogd kans op CSZ lokalisatie bij HIV, zie hoofdstuk CZS.
Lees meer >>
Voor uitgebreidere informatie over marginale zone lymfoom: zie NVvH/HOVON richtlijnen: https:/hovon.nl/en/treatment-guidelines/lymphoma/ Marginale zone lymfoom
Of: https://publicatie.hematologienederland.nl/richtlijnen/marginale-zone-lymfoom
Mucosa-Associated Lymphoma Tissue (MALT)-NHL ontstaat meestal t.g.v. een chronische antigene prikkel. Dit zijn in principe extra-nodale lymfomen van maagdarmkanaal, longen, mamma, speekselklieren, traanklieren, etc. 60% presenteert zich in de maag, vaak Helicobacter geassocieerd. Soms is het MALT lymfoom geassocieerd met auto-immuunziekte (M. Sjögren).
De meerderheid van MALT-lymfomen presenteert zich als stadium I/II.
De behandeling van het MALT-lymfoom is identiek aan andere vormen van nodale/extranodale indolente lymfomen (met eenzelfde stadium).
Bijzonder type: MALT-lymfoom van de maag. Diagnostiek: standaard lymfoom stagering, maar ook: gastric mapping (> 10 biopten), Helicobacter kweek (H pylori en H. Heilmannii). Bij negatieve biopten (vaker tijdens protonpompremmers): Helicobacter serologie bepalen. Endo-echo. van de maag om lokale uitbreiding vast te stellen (diepte infiltratie in wand en lokale lymfklieren).
Therapie MALT lymfoom van de maag, stadium IE: H. Pylori eradicatie. De kans op succes is 70-90% (mediaan na 6 maanden), en hangt af van de mate van uitbreiding (endo-echoscopie). Vaak blijven monoclonale B-cellen immunologisch aantoonbaar. Dit heeft geen betekenis.
t(11;18) positieve MALT-lymfomen zijn doorgaans resistent tegen HP-eradicatie.
Follow-up na HP eradicatie therapie: HP-eradicatie na 6 weken controleren (ureum ademtest) 3 maanden na therapie controle gastroscopie met gastric mapping. Hierna elke 4-6 maanden tot CR (kan wel 2 jaar duren)Daarna jaarlijkse controle.
Therapie van H.Pylori negatief MALT lymfoom (serologie en ureumademtest negatief, bij 10%): 20% reageert wel op eradicatietherapie.
MALT lymfoom dat niet reageert op eradicatie therapie (vaker bij t(11;18) en uitgebreidere lokalisatie): 30 Gy involved field radiotherapie (maag en perigastrische klieren).
Schema eradicatie Helicobacter Pylori (volgens afd. Microbiologie Erasmus MC)
- Pantopac® 2dd 1 tablet p.o. x 7 dagen (combinatiepreparaat, bevat pantoprazol, amoxicilline en clarithromycine) (voorkeur) (14 dagen behandeling is effectiever dan 7 dagen).
Óf:
- Amoxycilline 2x 1000 mg p.o. x 7 dagen én
- Claritromycine (Klacid®) 2x 500 mg p.o. x 7 dagen én
- Omeprazol (Losec®) 2 x 20 mg p.o. x 7 dagen.
Amoxicilline eventueel vervangen door:
- Metronidazol (Flagyl®) 3x 500 mg p.o. x 7 dagen.
Lees meer >>
Voor uitgebreidere informatie mbt de NVvH/HOVON richtlijnen: https:/hovon.nl/en/treatment-guidelines/lymphoma/ Folliculair Lymphoma guideline
Of: https://publicatie.hematologienederland.nl/richtlijnen/folliculair-lymfoom
Folliculaire lymfomen worden wel ingedeeld naar het aantal centroblasten per high power filed (hpf) (graad 1: < 5, graad 2: 6-15% centroblasten). Bij > 15 centroblasten per hpf is er sprake van graad 3. Graad 3 wordt onderverdeeld in graad 3a: nog centrocyten aanwezig, en graad 3b: follikels met voornamelijk grote blastaire cellen.
FL graad 3b wordt behandeld als DLBCL.
Initiële therapie
Stadium I/II
(stadium I of stadium II met maximaal 2 aangrenzende aangedane lymfklierregio’s; uitgebreider stadium uitsluiten met PET-CT)
- Involved field radiotherapie (12 x 2 Gy) geeft langdurige ziektevrije overleving, en kans op curatie.
Stadium III/IV (en stadium II indien niet in aanmerking komend voor curatieve radiotherapie)
- Expectatief (watch and wait beleid), tenzij:
- B-symptomen, verhoogd LDH
- progressie binnen 3 maanden
- symptomatische organomegalie, (dreigende) obstructie of beenmergfalen
- bulky disease, hinderlijke lymfadenopathie
- Indien indicatie voor behandeling: 8 x R-CVP, als CR of PR is bereikt onderhoudsbehandeling rituximab 1 x per 3 maanden, IV of subcutaan gedurende 2 jaar, of tot progressie indien dit eerder optreedt. (bij hoge FLIPI (3-5) kan 6 x R-CHOP worden overwogen of 6 x R-bendamustine
R-CVP
| Rituximab |
375 mg/m2 i.v |
dag 1 |
| Cyclofosfamide |
750 mg/m2 i.v. |
dag 1 |
| Vincristine |
2 mg i.v. |
dag 1 |
| Prednison |
40 mg/m2. p.o. |
dag 1-5 |
| Kuur herhalen op dag 22 |
R-bendamustine
| Rituximab |
375 mg/m2 i.v |
dag 1 |
| Bendamustine |
90 mg/m2 i.v. |
dag 1 en 2 |
| Kuur herhalen op dag 28 |
- Frail elderly: rituximab + chloorambucil (10 mg p.o. dag 1-14 óf 10 mg/m2 p.o. dag 1-7) 6-12 x, à 4 weken. Indien low tumor burden: eventueel rituximab monotherapie (rituximab 375 mg/m2 i.v. dag 1, 8, 15, 22, evt. gevolgd door onderhoudsbehandeling. Alternatief is ook lokale behandeling met 2 x 2 Gy radiotherapie.
2e lijns therapie (en later)
Folliculair lymfoom is niet curatief te behandelen (behalve met allogene stamceltransplantatie). Vroege en late recidieven treden op. 2e lijns behandeling en behandeling van latere recidieven hangt af van eerdere therapieën en de respons daarop. Bij verdenking op recidief nieuw biopt, ook om transformatie uit te sluiten.
Voor behandeling in studieverband: raadpleeg altijd de HOVON/LLPC website.
Algemene principes
- Bij relatief asymptomatische ziekte: watch and wait
- Indien de responsduur op vorige therapie > 12-24 maanden is, kan dezelfde therapie worden herhaald (uitzondering: anthracycline bevattend schema)
- Indien de responsduur op vorige therapie < 12-24 maanden is, kies dan voor “niet kruis resistent” schema.
- Indien geen PR of CR op rituximab bevattend schema (tenminste 4 kuren), of recidief/progressie tijdens of binnen 6 maanden na rituximab bevattende inductie- of onderhoudsbehandeling, dan wordt dit beschouwd als rituximab refractair.
- In de tweede lijn is na re-inductie, als niet rituximab refractair, onderhoudsbehandeling met rituximab 1 x per 3 maanden geïndiceerd, gedurende 2 jaar, of tot progressie indien dit eerder optreedt.
- Overleg over indicatie tot allogene stamceltransplantatie (≤ 70 jaar) bij 2e of latere recidief.
2e of 3e lijn
- Indien niet eerder met chemotherapie behandeld: zie eerstelijnsbehandeling
- Recidief laat na R-CVP: overweeg R-CVP te herhalen, zie algemene principes
- Andere schema’s: 6 x R-bendamustine, 6 x R-FC (of R-Fludarabine 40 mg/m2 dag 1-5 bij geringe BM reserve). 6 x R-CHOP
- Minder intensieve schema’s: rituximab + chloorambucil (10 mg p.o. dag 1-14 óf 10 mg/m2 p.o. dag 1-7) 6-12 x, à 4 weken. Rituximab monotherapie (rituximab 375 mg/m2 i.v. dag 1, 8, 15, 22).
Of 2 x 2 Gy radiotherapie.
- R-lenalidomide, 12 cycli
R-FC
| Rituximab |
375 mg/m2 i.v. |
dag 1 |
| Fludarabine |
40 mg/m2 p.o. |
dag 1-3 |
| Cyclofosfamide |
250 mg/m2 p.o. |
dag 1-3 |
| Kuur herhalen op dag 29 |
bij respons 6 kuren |
| profylaxe met cotrimoxazol 480 mg en valaciclovir 2 x 500 mg per dag |
R-lenalidomide
| Rituximab |
375 mg/m2 i.v. |
dag 1 |
| Lenalidomide* |
20 mg p.o. |
dag 1-21 |
| Kuur herhalen op dag 29 |
bij response 12 kuren |
*Lenalidomide (10 mg bij kreatinineklaring 30-59 mL/min.)
Overweeg ascal of antistolling profylaxe |
Indien rituximab refractair:
- Obinutuzumab/bendamustine 90 mg/m2, dag 1 en 2, à 4 weken.
- Indien anti-CD20 i.v.m. overgevoeligheid niet mogelijk: bendamustine 120 mg/m2, dag 1 en 2, à 4 weken
- Idelalisib 2 dd 150 mg per os, tot progressie. N.B. indicatie indien refractair op 2 eerdere therapielijnen. Denk aan PJP en VZV/HSV profylaxe, en wees bedacht op CMV infectie indien CMV serologie positief. Check CMV-PCR.
Obinutuzumab/bendamustine schema:
Obinutuzumab 1000 mg i.v. dag 1, 8, 15 van kuur 1; dag 1 van kuren 2-6; bendamustine 90 mg/m2 i.v. dag 1,2, alle kuren
Getransformeerd lymfoom
- Indien niet eerder behandeld voor het FL: inductie zoals eerstelijns behandeling van DLBCL (Autologe stamceltransplantatie als consolidatie geeft geen overlevingsvoordeel. Geen indicatie voor rituximab onderhoudsbehandeling)
- Indien de patiënt eerder behandeld is voor het FL: inductie met R-CHOP-21, 6x (of 3 x R-GDP of R-DHAP indien patiënt al R-CHOP heeft gekregen), gevolgd door consolidatie met een autologe stamceltransplantatie.
Recidief getransformeerd lymfoom
Dit wordt behandeld als DLBCL (zie ook studies DLBCL: soms wel, soms niet mogelijk)
Lees meer >>
Voor uitgebreidere informatie mbt de NVvH/HOVON richtlijnen: https:/hovon.nl/en/treatment-guidelines_leukemia/ klassieke haarcelleukemie guideline
Of: https://publicatie.hematologienederland.nl/richtlijnen/klassieke-haarcelleukemie-classic-hairy-leukemia-hclc
Criteria
- Pancytopenie en splenomegalie.
- Weinig circulerende maligne cellen; kenmerkende morfologie (harige cellen).
- Monocytopenie.
- Fenotype: sIgM (D/A/G) Kappa of Lambda, CD19+, CD20+, CD22+, CD103+, CD11c+, CD25+, CD5-, CD10-, CD23-.
- Dry tap (door reticuline ++), typische BM histologie
- BRAF V600E mutatie
Behandeling
Behandeling is geïndiceerd bij (symptomatische) cytopenie, pijnlijke splenomegalie of extreme moeheid. Watchful waiting is in andere gevallen een goede optie.
- 2-CDA (Cladribine) 0.14 mg/kg/dag in 2 uur i.v. gedurende 5 dagen.
- Bij bereiken PR met significante hoeveelheid rest HCL behandeling na 6 maanden herhalen, met toevoegen van rituximab 375 mg/m2 wekelijks, 8 maal.
- Recidief: 2-CDA herhalen in combinatie met rituximab 375mg/m2 wekelijks, 8 maal, te starten 1 maand na 2-CDA.
- Vroeg symptomatisch recidief (binnen 2 jaar): bepaal BRAF V600E en hoog risicofactoren: ernstige anemie of massale milt bij diagnose, TP53 defecten (del(17p), TP53 mutatie), expressie IGHV4-34 rearrangement, ongemuteerd IGHV. Indien BRAFmutatie aantoonbaar, en hoog risico: Overweeg vemurafenib 2dd960, tenminste 8 weken, maximaal 24 weken (streef 16-18 weken), dosis aanpassingen op geleide van bijwerkingen. Alternatief 6x bendamustine 90 mg/m2 -rituximab a 4 weken.
- Bij resistentie: Interferon-α 1.5- 3.0 x 106 EH, s.c., 3x/week, gedurende minimaal 1 jaar, of kuur herhalen.
- Overweeg splenectomie indien refractair en splenomegalie en/of cytopenieën.
- Expectatief beleid is mogelijk bij stabiele patiënten (frequente controle) en Hb > 5.5, trombocyten > 60 en neutrofielen > 1.0.
Respons van behandeling bepalen 4-6 maanden na therapie.
Definitie complete remissie: normaal bloedbeeld, geen harige cellen in bloed en cristabiopt, normalisatie van miltgrootte. Restziekte bij flowcytometrie mag aanwezig zijn. Definitie partiële remissie: normaal bloedbeeld, ≥ 50% verbetering splenomegalie en beenmerginfiltratie, geen circulerende harige cellen.
NB: Cave: opportunistische infecties, zoals tuberculose, atypische Mycobacteriën (M.Avium), Pneumocystis Carinii, Toxoplasma etc.
Na einde 2-CDA-behandeling (niet tijdens ivm frequent ontwikkelen van rash) start cotrimoxazol 1 dd 480 mg en valaciclovir 2 x 500 mg, tot absoluut lymfocyten aantal > 1.
Tot 6 maanden na 2-CDA bestraalde bloedproducten
Lees meer >>
Volgens de laatste WHO classificatie (2023): Splenic B-cell lymphoma/leukaemia with prominent nucleoli.
Criteria
- iets andere morfologie dan echte hairy cells, prominente nucleolus;
- fenotypering: zoals hairy cell leukemia, maar meestal CD25- en/of CD103-;
- hoog leukocytengetal.
Behandeling
- Reageren meestal niet goed op 2-CDA of Interferon.
- een PR kan behaald worden in sommige patiënten met splenectomie of met cladribine in combinatie met rituximab.
- Alternatief R-CHOP. Bij falen FC.
Lees meer >>
Initiële therapie
Indien stadium I (zeldzaam!): 3x R-CHOP-21+ involved field radiotherapie (30-40 Gy)
Stadium II-IV:
- ≤ 65 jaar: R-CHOP alternerend met R-DHAP (totaal 6 kuren), gevolgd door autologe SCT. Daarna onderhoudsbehandeling met rituximab gedurende 3 jaar, 1x per 2 maanden.
- > 65 jaar: 6 kuren R-CHOP, gevolgd door rituximab onderhoudsbehandeling a 2 maanden.
Een enkele patiënt heeft een indolent verlopend MCL. Een expectatief beleid is dan verantwoord.
Recidief mantelcellymfoom
Vrijwel alle patiënten zullen vroeg of laat progressie dan wel recidief van de ziekte ontwikkelen. De keuze van behandeling hangt o.a. af van leeftijd en eerdere behandeling.
< 65 jaar: overleg over indicatie tot allogene stamceltransplantatie (wordt alleen toegepast als consolidatie na behandeling van eerste recidief)
Indien recidief > 2 jaar na 1e lijnsbehandeling:
- Hoge dosis cytarabine is een belangrijk onderdeel van de behandeling van mantelcellymfoom. Indien een patiënt dit in de eerste lijn niet heeft gehad is reinductie met R-DHAP de eerste keus.
- Indien al HD-ARA-C gehad: R-bendamustine (bendamustine 90 mg/m2 i.v. d1-2, herhalen d 29, bij response 6 kuren). Alternatief: R-FC (FC: fludarabine 40 mg/m2, p.o., d1-3, cyclofosfamide 250 mg/m2, p.o, d 1-3, herhalen d 29, bij respons 6 kuren). (Bij FC kuren profylaxe met cotrimoxazol 480 mg en valaciclovir 2 x 500 mg per dag.)
- > 65 jaar: indien in eerste lijn R-CHOP dan R-bendamustine. Indien in eerste lijn R-FC dan R-CHOP. Alternatief: R-HAD (cytarabine 1000 mg/m2 2dd i.v. dag 1, dexamethason 20 mg p.o. of i.v., dag1-4).
Frail elderly: chlorambucil continu.
Lokale palliatie: overweeg radiotherapie.
Indien recidief binnen 2 jaar na 1e lijnsbehandeling, of 2e recidief:
Ibrutinib 560 mg 1 dd per os, tot progressie of niet acceptabele toxiciteit
Lees meer >>
Perifere T cel lymfomen zijn zeer divers en een algemeen advies is dan ook niet goed te geven. Kijk voor advies bij de specifieke entiteiten.
Behandeling in studieverband heeft altijd de voorkeur, gezien het weinig frequente voorkomen en de in het algemeen slechte prognose.
Revisie van de PA diagnose door een ervaren hemato-patholoog is altijd vereist.
Initiële behandeling
| stadium |
T-NHL |
Therapie ≤ 65 jaar |
Therapie > 65 jaar |
opmerking |
| Stadium I |
PTCL-NOS
ALCL
AITL* |
3 x CHOEP21+IF-RT |
3 x CHOP21 + IF-RT |
*Indien EBV positieve AITL rituximab toevoegen |
| Stadium II-IV |
PTCL-NOS
AITL*
Primair cutaan ɣ-ɖ T-NHL
EATL
ALCL ALK negatief |
6 x CHOEP14 + ASCT na BEAM |
6 x CHOP21 (t/m 70 jaar gevolgd door ASCT na BEAM) |
*Indien EBV positieve AITL rituximab toevoegen |
| Stadium II-IV |
ALCL ALK positief |
8 x CHOEP 14 |
6 x CHOP21 |
|
- Er is bij patiënten ≤ 65 jaar gekozen voor CHOEP omdat dit in een Duitse studie bij jongere patiënten een significant hogere 3-jaar EFS gaf in vergelijking met CHOP: 75% vs 51%. Er was geen overall survival winst (post-hoc analyse, Schmitz N, et al. Blood 2010). Data uit de Zweedse lymfoom registratie studie zijn hiermee in overeenstemming (Ellin F, et al. Blood 2014). Bij oudere patiënten is CHOEP te toxisch.
- Evaluatie van respons vindt plaats halverwege de behandeling (na 3 kuren) met CT scan en na afloop van de behandeling met een PET-diagnostische CT scan.
- Indien ASCT is voorzien in de eerstelijns behandeling dan vindt stamcelaferese plaats op de 4de kuur als er sprake is van een PR en negatief beenmerg na 3 kuren.
- Voor de patiëntencategorie 65-70 jaar is het van belang dat in de verwijzende ziekenhuizen adequate triage van deze patiënten plaatsvindt alvorens ze te verwijzen voor stamcelaferese en ASCT, inclusief longfunctie plus diffusiecapaciteit en linker ventrikel ejectiefractie.
CHOEP21
| Cyclofosfamide |
750 mg/m2 i.v. |
Dag 1 |
| Doxorubicine |
50 mg/m2 i.v. |
Dag 1 |
| Vincristine |
1.4 mg/m2 (max 2 mg) i.v. |
Dag 1 |
| Etoposide |
100 mg/m2 i.v. |
Dag 1-3 |
| Prednisolon |
100 mg p.o. |
Dag 1-5 |
Kuur herhalen op dag 22
Anti-emetica: granisetron en dexamethason (10 mg bolus) op dag 1-3 |
CHOEP14
| Cyclofosfamide |
750 mg/m2 i.v. |
Dag 1 |
| Doxorubicine |
50 mg/m2 i.v. |
Dag 1 |
| Vincristine |
1.4 mg/m2 (max 2 mg) i.v. |
Dag 1 |
| Etoposide |
100 mg/m2 i.v. |
Dag 1-3 |
| Prednisolon |
100 mg p.o. |
Dag 1-5 |
| Lipegfilgrastim |
6 mg s.c. |
Dag 4 |
Kuur herhalen op dag 15
Anti-emetica: granisetron en dexamethason (10 mg bolus) op dag 1-3 |
Dosisaanpassing CHOEP21 en CHOEP 14 schema
Indien voor het begin van de volgende kuur de leukocyten < 4 x 109/L en/of de trombocyten < 100 x 109/L zijn, dan de kuur 1 week uitstellen.
Indien na 1 week uitstel onvoldoende herstel: dosis aanpassen volgens onderstaand schema.
Leuko
x 109/L |
Trombo
x 109/L |
C |
H |
E |
O |
P |
| > 3 |
> 100 |
100 % |
100 % |
100 % |
100 % |
100 % |
| 2.0 -3.0 |
> 100 |
75 % |
75 % |
75 % |
100 % |
100 % |
| 1.0-2.0 |
50-100 |
50 % |
50 % |
50 % |
100 % |
100 % |
| < 1 |
< 50 |
0 % |
0 % |
0 % |
100 % |
100 % |
Recidief T-NHL
- Bij patiënten t/m 70 jaar en nog geen ASCT in 1ste lijn gehad: 2 x DHAP, indien PR, dan DHAP, stamcelaferese en ASCT na BEAM.
- Als eerder ASCT: overleg over indicatie tot allogene stamceltransplantatie (leeftijdsgrens t/m 65 jaar).
- Patiënten met een recidief T-cellymfoom dat CD30 positief is komen in aanmerking voor reinductie met brentuximab vedotin gevolgd door allogene SCT.
- Voor fase I-II studies: zie http://www.hovon.nl/werkgroepen/studiewerkgroepen/llpc.html en http://www.erasmusmc.nl/hematologie/speinf/
Zeldzame T-NHL entiteiten
Enteropathie geassocieerd T-cel lymfoom (EATL)
Primaire EATL ontstaat bij patiënten zonder een bekende coeliakie. Deze patiënten presenteren zich vaak met een acute buik met een tumor van de dunne darm, waarbij bij toeval coeliakie wordt geconstateerd (transglutamine-antistoftiter en HLA-DQ). De conditie van deze patiënten is vaak goed.
Secundaire EATL ontstaat bij patiënten reeds bekend met coeliakie of refractaire coeliakie. Bij deze patiënten wordt het ziektebeeld refractair op de behandeling met steeds meer afwijkende T-cellen in de ulcererende dunne darm, totdat het beeld evolueert tot een duidelijk T-NHL. Deze patiënten zijn vaak in een zeer slechte conditie.
Er is geen gevalideerde standaardbehandeling. De helft van de patiënten komt niet aan behandeling toe. Behandeling bestaat uit lokale debulking en resectie van de tumormassa om behandeling met chemotherapie mogelijk te maken (zie schema tabel initiële behandeling T-NHL). De meeste patiënten recidiveren snel en de 5-jaars overleving bedraagt 8-20%.
Recente studies laten veelbelovende resultaten zien van een meer intensieve voorbehandeling gevolgd door ASCT. Hierbij worden na een eerste CHOP kuur, 6 kuren ifosfamide, epirubicine, etoposide en HD-MTX gegeven, gevolgd door ASCT na BEAM. De 5 jaars overleving stijgt hiermee naar 50-60%. (Sieniawski M, et al. Blood 2010). Er zijn echter maar weinig patiënten die in aanmerking lijken te komen voor deze zeer intensieve behandeling, alleen patiënten in en zeer goede conditie zijn hiervoor geschikt.
Circa 50% van de EATL brengt CD30 tot expressie. In de recidief setting is dan ook plaats voor brentuximab-vedotin.
Hepato-splenisch gamma/delta T-cel lymfoom
Dit lymfoom komt wel voor bij patiënten met de ziekte van Crohn die behandeld worden met infliximab. Chronische immunosuppressie, zoals gezien wordt bij orgaantransplantaties is een sterke risicofactor. Bij presentatie bestaat vaak een pancytopenie, hepatosplenomegalie en zijn er B-symptomen. De prognose is slecht. Recent zijn bemoedigende resultaten beschreven na behandeling met DHAP gevolgd door ASCT na BEAM. (zie review Foppoli M, et al. Eur J Haematol 2014).
Speciale entiteit
NK-Tcel lymfoom
Dit agressieve lymfoom is altijd EBV positief. Kenmerkend is de vaso-invasieve groei. De ziekte is bij presentatie vaak gelokaliseerd in de neus-keelholte met doorgroei naar de sinussen, orbita, mondholte en het palatum. Er treedt snel disseminatie op. Soms komt EBV-gerelateerd hemofagocytair syndroom voor. De prognose was slecht, maar is enigszins verbeterd sinds hoge dosis radiotherapie wordt toegepast aan het begin van de behandeling en invoering van het SMILE schema.
Stadium I laag risico (Yang Y, et al. Blood 2015) = leeftijd < 60 jaar, LDH nl, ECOG PS 0-1, stadium I, geen primaire tumor invasie, hebben een goede prognose met hoge dosis lokale RT alleen (5-jaar OS 90%)
Stadium II starten met lokale RT gevolgd door chemotherapie: SMILE zou geen voordeel geven bij early stage ptn, dus inderdaad bij CHOP houden Stadium I/II, met lokalisatie in KNO gebied. “nasal”: eerst lokale radiotherapie (> 50 Gy) gevolgd door CHOP, eventueel sandwich: 3 x CHOP, dan RT, dan 3 x CHOP.
Stadium III/IV of non-nasal type: SMILE schema (klinisch):
SMILE-schema
| Methotrexaat |
2000 mg/m2 i.v |
dag 1 in 6 uur, 1 x daags |
| Folinezuur |
15 mg p.o. |
dag 2 t/m 4, 4 x daags |
| Etoposide |
100 mg/m2 i.v |
dag 2 t/m 4, in 2 uur 1 x daags |
| Ifosfamide |
1500 mg/m2 i.v |
dag 2 t/m 4, in 1 uur 1 x daags |
| Mesna |
10 mg/kg i.v |
dag 2 t/m 4, in 1 uur 1 x daags |
| Mesna |
20 mg/kg i.v |
dag 2 t/m 4, in 8 uur 1 x daags |
| Dexamethason |
40 mg i.v. |
dag 2 t/m 4, in 15 min 1 x daags |
| L-Asparaginase (Paronal) |
6.000 U/m2 i.v. |
dag 8, 10, 12, 14, 16, 18, 20 |
| Granisetron |
1 mg i.v. |
dag 1 t/m 4, als shot 2 x daags |
| Bij eerste kuur profylaxe met LMWH |
| Indien PR na 2 kuren door tot 4-6 kuren, en zo mogelijk consolidatie met autologe stamceltransplantatie. |
Lees meer >>
De meeste posttransplantatielymfomen zijn geassocieerd met Epstein-Barr Virus (EBV). De therapie bij posttransplantatie lymfoom na allogene stamceltransplantatie en na solide orgaan transplantatie is verschillend.
Post-allogene stamceltransplantatie
Voor de detectie, diagnostiek, preventie en behandeling van PTLD na allogene SCT wordt verwezen naar het document op KMS
Na solide orgaantransplantatie
De behandeling van PTLD na solide orgaan transplantatie (SOT) is een multidisciplinaire behandeling en gaat in nauwe samenwerking met behandelde transplantatiearts.
Het meest voorkomende PTLD na SOT is het DLBCL maar ook de subtypen B-cel lymfomen Burkitt, plasmablastair lymfoom en de subtypen T-cel NHL PTCL NOS, hepatospleen T-cel lymfoom en andere T-cel entiteiten komen voor.
WHO 2016 PTLD classificatie
| Type lesie |
Lokalisatie |
Lymfklier
architectuur |
Klonaliteit |
Respons
na behandeling |
| ‘Early lesions’ |
Tonsillen
adenoid of
nodaal |
Gepreserveerd |
Polyklonaal |
Kan reageren op
reductie in immuunsuppressie en RTX |
| Polymorf PTLD |
Nodaal en extranodaal |
Verstoord |
Polyklonaal/
monoklonaal |
Kan reageren op
reductie in immuunsuppressie en RTX |
| Monomorf PTLD |
Nodaal en extranodaal |
Verstoord |
Monoklonaal |
Reageert niet op reductie IS |
Klassiek Hodgkin
PTLD |
Nodaal en extranodaal |
Verstoord |
Monoklonaal |
Reageert goed op een anti-Hodgkin regime |
Stadiëring
- Zoals bij DLBCL
- De FDG PET scan heeft bij PTLD een hogere kans op vals positieve afwijkingen als gevolg van het gebruik van immunosuppressieve medicatie en het voorkomen van infecties. Dit dient bij de interpretatie van uitgangs- en eindevaluatiescans meegewogen te worden.
- EBV PCR
Behandeling
De behandeling van het Burkitt lymfoom, plasmablastair lymfoom, Hodgkin lymfoom, indolente B-cel lymfoom en T-cel lymfoom wordt volgens de voor deze entiteiten geldende richtlijnen behandeld.
Hier betreft het de behandeling van DLBCL.
- Staken of verminderen immunosuppressie Dit gebeurt altijd in samenspraak met de behandelende transplantatie arts. Gestreefd wordt naar tenminste 30-50% reductie van de immuunsuppressie.
- .Bij “vroege lesies” en polymorfe PTLD
- reductie van immunosuppressieve medicatie indien mogelijk
- evaluatie na 4 tot 6 weken
- indien reductie in IS niet mogelijk of niet tot regressie leidt, behandelen als monomorf PTLD
- Monomorf PTLD
- 4x Rituximab á 1 week
- evaluatie middels FDG PET scan met diagnostische CT na tenminste 4 weken
- Bij CR: nog 4 x rituximab á 21 dagen
- Bij PR (gedefinieerd als tenminste 50% reductie in SPD van targetlaesies bij nog Deauville score hoger dan 3):
- nog 4 x R-CHOP á 21 dagen gevolgd door een eindevaluatie FDG PET scan na tenminste 6 weken
- Bij alles minder dan PR:
- nog 6 x R-CHOP á 21 dagen met interim CT-scan na 3 kuren en eindevaluatie FDG PET scan met diagnostische CT na 6 kuren
- Indien als gevolg van snel progressieve ziekte, of orgaan bedreigende laesies niet gewacht kan worden op het effect van rituximab kan er voor gekozen worden te starten met R-CHOP. Bij respons na een kuur kan alsnog worden gecontinueerd met rituximab volgens bovenstaand schema.
- Bij recidief geen standaard therapie.
Lees meer >>
WHO-EORTC-classificatie voor cutane lymfomen (Blood 105: 3768-3785)
| Cutaneous T-cell and NK cell lymphomas |
| |
Mycosis fungoides (MF) |
| |
MF variants and subtypes |
| |
|
Folliculotropic MF Pagetoid reticulosis |
| |
|
Granulomatous slack skin |
| |
Sezary Syndrome (SS) |
| |
Adult T-cell leukemia/lymphoma |
| |
Primary cutaneous CD30+ lymphoproliferative disorders |
| |
|
Primary cutaneous anaplastic large cell lymphoma |
| |
|
Lymphomatois papillosis |
| |
Subcutaneous panniculitis-like T-cell lymphoma |
| |
Extranodal NK/T-cell lymphoma, nasal type |
| |
Primary cutaneous peripheral T-cell lymphoma, unspecified |
| |
|
Primary cutaneous aggressive epidermotropic CD8+ T-cell lymphoma (provisional) |
| |
|
Cutaneous gamma/delta T-cell lymphoma |
| |
|
Primary cutaneous CD4+ small/medium-sized pleomorphic T-cell lymphoma (provisional) |
| |
|
|
| Cutaneous B-cell lymphomas |
| |
Primary cutaneous marginal zone B-cell lymphoma |
| |
Primary cutaneous follicle center lymphoma |
| |
Primary cutaneous diffuse large B-cell lymphoma, leg type |
| |
Primary cutaneous diffuse large B-cell lymphoma, other |
| |
|
Intravascular large B-cell lymphoma |
| |
|
|
| Precursor hematologic neoplasm |
| |
CD4+/CD56+ hematodermic neoplasm (blastic NK-cell lymphoma) blastic plasmacytoid dendritic cell neoplasm |
Stadiumclassificatie voor mycosis fungoides en Sézary-syndroom
| Stadium |
|
5 jaars OS (%) |
| IA |
Limited patches en plaques < 10% lichaamsoppervlak |
96-100 |
| IB |
Patches en plaques ≥ 10% lichaamsoppervlak |
73-86 |
| IC |
Patches plaques en cutane tumoren |
|
| IIA |
Plaques met lymfeklieren (geen CTCL in PA) |
49-73 |
| IIB |
Tumoren met lymfeklieren |
40-65 |
| III |
Gegeneraliseerde erythrodermie met positieve histologie |
40-57 |
| IVA |
Lymfeklieren met in lnnCTCL |
15-40 |
| IVB |
Viscerale uitbreiding |
0-15 |
Behandeling: multidisciplinair in overleg met dermatoloog (consult dermatoloog).
Mycosis fungoides/Sezar syndrome
Trautinger F. et al. EORTC consensus recommendations for the treatment of mycosis fungoides/Sézary syndrome. Eur J Cancer 2006; 42: 1014-1030.
EORTC consensus aanbevelingen behandeling mycosis fungoides
| Stadium |
1e lijns behandeling |
2e lijns behandeling |
| IA-IB-IC-IIA |
Expectatief |
Bexaroteen po |
| PUVA (voorkeur orale PUVA) |
IFN-α monotherapie |
| UVB (alleen voor patches) |
IFN-α + retinoiden |
| Topicale corticosteroiden klasse IV |
Lage dosis MTX |
| Locale radiotherapie |
IFN-α + PUVA |
| TSEB (total skin electron beam in LUMC) bij groot oppervlak |
Retinoiden + PUVA |
| Topicale chloormethine (momenteel niet realiseerbaar in NL) |
Bexaroteen + PUVA |
| Bexaroteen gel (in NL weinig ervaring) |
|
| IIB |
PUVA + IFN-α |
Bexaroteen po |
| TSEB (LUMC) |
Chemotherapie: CHOP, Fludarabine, Peg. liposomaal doxorubicine, gemcitabine |
| Retinoiden + IFN-α |
|
| III |
PUVA + IFN-α |
Bexaroteen po |
| IFN-α |
Chemotherapie: CHOP, Fludarabine, Peg. liposomaal doxorubicine, gemcitabine |
| Lage dosis MTX |
|
| TSEB (LUMC)/ Radiotherapie |
|
| ECP (in NL niet beschikbaar) |
|
| IVA – IVB |
Chemotherapie: CHOP, Fludarabine, Peg. liposomaal doxorubicine, gemcitabine
TSEB en/of radiotherapie (LUMC)
Bexaroteen
IFN-α
Alemtuzumab
Lage dosis MTX
Pm autologe of allogene SCT |
|
Bexaroteen
Klasse: retinoid X receptor (RXR)-selectieve retinoid agonist.
Dosis: start 150 mg/m2 2-4 weken, daarna 300 mg/m2 (capsules a 75 mg).
Werking treedt soms pas laat op (na 12 weken), dus zeker 16 weken behandelen.
Bijwerkingen: o.a. centrale hypothyreoidie, ernstige hypertriglyceridemie en hypercholesterolemie.
Contra-indicatie: familiaire hyperlipaedemie.
Bexaroteen behandelschema:
- Voor therapie baseline lab afnemen: nuchter triglyceriden, totaal cholesterol, LDL- en HDL-cholesterol, TSH, T4 en vrije T4. Deze moeten normaal zijn voor start bexaroteen.
- Dag -7 start atorvastatine 1 dd 10 mg (’s avonds innemen).
- Dag -7 start L-thyroxine 1 dd 50 microgram en bexaroteen 1 dd 150 mg/m2.
- Dag 7 controle lab (als baseline), evt aanpassen medicatie.
- Dag 14, 21, 28, 35, 49 en daarna iedere 1 a 2 maanden controle lab.
- Na 2 tot 4 weken als bexaroteen goed wordt verdragen ophogen dosis naar 300 mg/m2.
- Bij staken bexaroteen de L-thyroxine staken na 3 dagen en de antilipiden na 1 week.
EORTC consensus aanbevelingen behandeling Sézary syndroom
| 1e lijns behandeling |
2e lijns behandeling |
| ECP (niet in NL beschikbaar) |
Bexaroteen |
| IFN-α |
Chemotherapie: CHOP |
| Chloorambucil-prednison |
Alemtuzumab |
| |
Lage dosis MTX |
| Studie Sézary syndroom in LUMC dermatoloog M.H. Vermeer (via dermatoloog) |
Cutaan B-cel lymfoom
Primair cutaan marginale zone B-cel lymfoom
- Zelden associatie met Borrelia burgdorferi infectie (dan met antibiotica behandelen!).
- Vaak beperkt tot huid, solitair of multifocaal.
- Prognose uitstekend: 5 jaars overleving 98%.
- Therapie:
- 1e keus radiotherapie
- chirurgie.
- Intralesionaal steroiden
- Intralesionale/sc IFN alpha.
- Wait and see, chloorambucil, rituximab conform indolente lymfomen.
Primair cutaan follikel centrum lymfoom
- Solitair of gegroepeerde lesies, zelden multifocaal, dissemineert bijna nooit.
- Prognose uitstekend (ook indien multifocaal): 5 jaars overleving 95%.
- Therapie:
- 1e keus radiotherapie (ook bij grootcellig infiltraat).
- Recidieven kunnen wederom met radiotherapie behandeld worden.
- R-CHOP alleen bij zeer uitgebreide huidlokalisaties of systemische ziekte.
Primair cutaan grootcellig B-cel lymfoom (leg type)
- Rode tumoren op onderbenen (bij 10% elders op huid).
- Dissemineren frequent.
- Prognosis: 5 jaars overleving 50%.
- Multifocale ziekte slechtere prognose.
- Therapie: als DLBCL (R-CHOP), evt radiotherapie.
Lees meer >>
Criteria
- Splenomegalie, lymfocytosis en cytopenie (door hypersplenisme)
- Zelden lymfadenopathie
- Al of niet met villeuze lymfocyten (korte villi, soms plasmacytoid)
- Fenotype: sIgM(D) Kappa of Lambda, CD19+, CD20+, CD22+, CD5-, CD10-, CD103-.
- Deel heeft associatie met hepatitis C infectie
- 10-40% M proteine
- Meestal indolent beloop, mediane overleving > 10 jaar.
- Zoals bij veel indolente lymfomen is transformatie mogelijk
Behandeling
- Bij hepatitis C infectie: antivirale therapie
- Indien asymptomatisch zonder cytopenie kan worden afgewacht
- Goede respons op splenectomie bij symptomatische splenomegalie en/of cytopenie
- Indien toch chemotherapie: relatieve resistentie voor alkylerende middelen. Voorkeur voor rituximab monotherapie (375 mg/m2 1x per week, 4 weken, of R-Fludarabine 40 mg/m2 d 1-5.
Lees meer >>
Voor uitgebreidere informatie mbt de NVvH/HOVON richtlijnen: https:/hovon.nl/en/treatment-guidelines/lymphoma/ Morbus Waldenstrom guideline
Of: https://publicatie.hematologienederland.nl/richtlijnen/waldenstroms-macroglobulinemie
Diagnostische criteria M. Waldenstrom
- IgM M-component en
- Beenmerginfiltratie door kleine lymfocyten met plasmacytoide kenmerken (lymfoplasmocellulair infiltraat) en plasmacellen
- sIgM+, CD22+, CD19+, CD20+, CD25+, CD27+, CD5-, CD10-, CD23-, CD138-, CD103-, FMC7+. (de plasmacellen zijn CD138+)
- MYD88L265P mutatie (sterk aanbevolen, bij > 90% van de MW patiënten aanwezig)
Een IgM component alleen is niet voldoende voor de diagnose MW, kan namelijk ook voorkomen bij andere lymfoproliferatieve ziekten
Indien IgM paraproteine ontbreekt wordt de term lymfoplasmacytair lymfoom (LPL) gebruikt.
Diagnostisch onderzoek
- Conform algemene lymfoomanalyse +.
- M-proteine +immunofixatie.
- Cryoglobulinen, koude-agglutininen.
- Beta-2 microglobuline en albumine (prognostische markers)
- Serum viscositeit, consult oogarts bij mogelijke hyperviscositeit
- PT en aptt.
- Eventueel lymfeklierhistologie (incl. gerichte immunohistochemie)
- CT-hals/thorax/abdomen.
- Consult neurologie bij klachten van polyneuropathie (IgM gericht tegen myeline geassocieerde glycoproteinen)
- Op indicatie uitsluiten amyloidose
Behandeling
- Asymptomatische M. Waldenström: expectatief beleid.
- Indien symptomen van hyperviscositeit: plasmaferese in acute fase, in afwachting op respons op chemotherapie.
Behandelindicaties*
| Hemoglobine ≤6.2 mmol/L |
| Trombocytengetal <100×109/L |
| Koorts, nachtzweten, gewichtsverlies, vermoeidheid |
| Hyperviscositeit |
Sympomatische en/of bulky lymfadenopathie (≥5cm maximale
diameter) |
| Symptomatische hepatomegalie en/of splenomegalie |
| Symptomatische organomegalie en/of weefselinfiltratie |
| Perifere neuropathie |
| Symptomatische cryoglobulinemie |
| Koude agglutinine gerelateerde anemie |
| Auto-immuun hemolytische anemie en/of trombopenie |
| Nefropathie gerelateerd aan WM |
| Amyloidose gerelateerd aan WM |
| *Mits WM gerelateerd |
Initiële therapie
6-8 x DRC.
Na rituximab kan in eerste instantie een IgM “flare” optreden. Bij IgM > 40 g/l rituximab pas toevoegen als IgM na de chemo is gedaald.
DRC
| Dexamethason |
20 mg i.v. |
dag 1 |
| Rituximab |
375 mg/m2 i.v |
dag 1 |
| Cyclofosfamide |
100 mg/m2 2 dd per os |
dag 1-5 |
| Kuur herhalen op dag 22 |
| Rituximab pas starten als IgM < 40 g/L |
| Bij symptomatische hyperviscositeit naast plasmaferese een snel werkende behandeling kiezen, bv R-bendamustine |
Zie voor alternatieven en motivatie de richtlijn.
2e lijns therapie en later
Zie ook de richtlijn.
Behandeling is pas geïndiceerd bij symptomen.
Lees meer >>

